甚麼是 5q 型脊髓性肌肉萎縮症?
脊髓性肌肉萎縮症 (Spinal Muscular Atrophy,簡稱SMA),據估計每6,000至10,000新生嬰兒中,就有 1人受到影響1,是因遺傳疾病導致嬰兒死亡的主因2。它是一群由脊髓前角神經細胞 (稱為運動神經元) 衰退,導致肌肉無力和萎縮的遺傳性神經肌肉疾病。這些神經元調控人體的隨意肌肉,影響如爬行、步行、舉起手臂、用手握住物體、移動頭部和頸部、呼吸和吞嚥等等的活動。
最常見的SMA形式是 5q 型脊髓性肌肉萎縮症 (5q Spinal Muscular Atrophy,簡稱5q-SMA),約佔所有SMA病例中95%3,是由位於第五號染色體的運動神經元存活 (Survival Motor Neuron gene 1,簡稱SMN1) 基因缺失或突變所引起的。 該基因負責製造運動神經元存活(SMN)蛋白,對維持運動神經元健康及正常功能至關重要。 5q-SMA患者因SMN1基因缺陷,沒法產生足夠SMN蛋白,讓運動神經元正常運作,使肌肉無法接收大腦的信號,進而導致骨骼肌進行性萎縮。
還有其它一些形式的SMA不是由SMN1基因的突變所致,它們的形式種類繁多 (例如SMARD伴有呼吸窘迫SMA、遠端SMA等等) ,病因和症狀有很大的差異,被稱為非5q型SMA,而本頁以下內容當提及SMA純粹是指5q-SMA。
有何類型和症狀1,4?
SMA對每個患者所造成的影響都不同,嚴重程度通常與發病年齡相關。 一般肌肉萎縮呈對稱性、下肢較上肢嚴重且身體近端 (靠近身體主幹的肌肉,如肩部,臀部,大腿和上背部肌肉)較遠端 (如手和腳) 易受影響。深腱反射减弱,甚至消失也常見。在嚴重的SMA病例中,吞嚥和呼吸功能也會受到影響。SMA患者智力發育及感覺均正常。
根據不同發病年齡及所能達到的最高運動功能(比如獨自坐稳、站立或行走),臨床上一般將SMA分為4種類型 – 從 I 型到 IV 型(表1)。但需要注意的是,這些“類型”不是嚴格的類別,即使是同一類型的患者,其病發速度及症狀也可有頗大的差異。
表 1 – SMA 的臨床分類
| 類型 | 病發年齡 | 壽命 | 最高運動功能 |
| 類型 I (嚴重) | 產前至嬰兒6個月大 | 2歲以下 | 無法獨立坐穩 |
| 類型 II (中級) | 6-18個月 | 2歲以上 | 坐立,但無法自行走路 |
| 類型 III (溫和) | 18個月至17歲 | 成人 | 自行走路 |
| 類型 IV (成人) | 18歲以上 | 正常 | 自行走路 |
表 1 – SMA 的臨床分類
| 類型 I (嚴重) |
|---|
| 病發年齡︰ 產前至嬰兒6個月大 壽命︰2歲以下 最高運動功能︰ 無法獨立坐穩 |
| 類型 II (中級) |
| 病發年齡︰ 6-18個月 壽命︰2歲以上 最高運動功能︰ 坐立,但無法自行走路 |
| 類型 III (溫和) |
| 病發年齡︰18個月至17歲 壽命︰成人 最高運動功能︰ 自行走路 |
| 類型 IV (成人) |
| 病發年齡︰ 18歲以上 壽命︰ 正常 最高運動功能︰ 自行走路 |
- SMA I 型
也稱為 Werdnig-Hoffman病或嚴重的嬰兒型SMA,是最嚴重和最常見的形式,佔兒童期SMA的50-70%。 一般父母在嬰兒出生後的前6個月會注意到嬰兒無法獨坐,哭聲微弱,吞嚥和進食困難等最初的症狀 (有些嬰兒甚至在出生前就被診斷出患有此病)。
患有SMA I型的嬰兒,看起來全身軟趴趴,他們的肌肉張力顯著低下,肌肉呈現嚴重無力,仰臥時下肢會呈現像青蛙一樣的外翻姿勢。患者永遠沒有獨立穩坐,抬起頭,翻身或爬行的能力。他們通常有嚴重吞嚥、餵食及呼吸困難,吸入性肺炎是他們死亡的重要成因。脊柱側凸和舌束顫動是很常見。 SMA I型起病急,病情重,患者一般在2歲前去世。然而,通過使用支援性的方法,例如使用機械吹氣排氣裝置,胃管餵養和無創通氣,預期壽命可能大幅延至兒童晚期,甚至成年期。年長的SMA I型兒童也會出現脊柱側凸(脊柱彎曲)。 - SMA II 型
也稱為 Dubowitz疾病或中性嬰兒SMA。嬰兒經常在6-18個月之間出現症狀 (儘管在出生後的最初幾個月,可能會注意到弱的肌張力)。受影響的嬰兒可以獨立坐著 (部份患者會隨著長大,喪失這種能力),但無法自行走路,肌腱反射減低,甚至消失,會出現遠端手震顫。在II型患者中,肺部和餵養問題,以及脊柱側凸也很常見,但與I型嬰兒相比,其病情較輕,且病發較緩慢。SMA II型患者病發速度有很大差異,預期壽命可以從幼兒期到成年期,取決於患者病情的嚴重程度。 - SMA III 型
也稱為 Kugelberg-Welander病。受影響的患者在18個月至17歲之間出現症狀。SMA III型兒童能獨立行走,儘管其中大約一半,最終會在成年之前失去行走能力。大多數患者隨著長大最終走起路来步履蹒跚,會經常摔倒,及從坐姿起立有困難。他們經常有輕微的手指震顫,但兒童時期的餵養和吞嚥問題並不常見。部份患者會發展脊柱側凸,需要支具或手術矯正。與正常人相比,預期壽命沒有顯著差異。 - SMA IV 型
其特徵在於成人時才發病,大多數報道的 SMA IV型病例,都是在30歲後病發 (儘管也有些患者在青少年晚期和成年早期被診斷出來),並且行動能力正常。虛弱是漸進的,首先影響大腿和臀部,然後影響上臂和肩膀。疲勞很普遍,患者經常出現肌疼痛。預期壽命正常,呼吸和吞嚥功能很少受到影響。
遺傳病因?
SMA是由位於5號染色體上的運動神經元存活 1(SMN1)基因的部分或完全缺失或小突變引起的,該基因負責產生一種很重要的蛋白質,稱為運動神經元存活(SMN)蛋白。 SMN蛋白遍佈全身,但主要存在於脊髓中。 SMN蛋白在維持稱為運動神經元的特化運動神經細胞的正常功能至關重要。這些運動神經元存在於腦幹(連接到脊髓的大腦的一部分)和脊髓中,並且將來自大腦和脊髓的信號傳遞到調控運動和肌肉收縮的骨骼肌。如果沒有足夠的SMN蛋白,運動神經元就不能保持健康狀態,甚至死亡,因此減弱了隨意肌肉運動的控制,這反過來導致骨骼肌的虛弱和消耗。最終說話、吞嚥、呼吸、坐立和走路的肌肉都會受到影響。
最常見的突變類型,主要為 SMN1基因發生部分或完全缺失 (deletion) 或轉換 (conversion) 突變 (共佔 95% 的SMA患者)3。在基因轉換中,SMN1基因變為類似SMN2基因,其第七外顯子中的 ‘C’ 變為 ‘T’。 其餘5%的SMA患者只有一個SMN1基因缺乏第七外顯子7,但另一個SMN1基因有點子突變3。(圖 1.1 ~ 1.3)
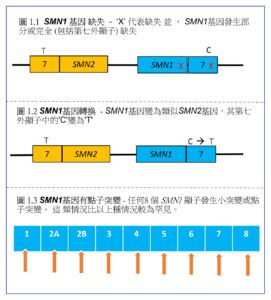
另一個基因,稱為運動神經元存活2(SMN2)基因,具有與SMN1基因相似的結構,但第七外顯子中的核苷酸 ‘C’ 變為 ‘T’,僅製造少量(約10%)5具完整功能的SMN蛋白,只能部分補償因SMN1基因突變引起的SMN蛋白缺乏。 SMN2基因的數量在正常人中有異,但SMA患者總是攜帶至少1個SMN2基因1。
基因病變攜帶者
SMA基因病變攜帶者出現的頻率,估計每40-60人中就有1人1。 它通過常染色體隱性遺傳發生,這意味著 SMA患者的父母通常都是基因病變攜帶者(即是父母各人皆有一個健康的SMN1基因和一個有缺陷的SMN1基因),而孩子因同時繼承了來自父母的有缺陷SMN1基因,才有可能罹患SMA。
SMA基因病變攜帶者一般沒有症狀,但有缺陷的基因可以遺傳給他們的孩子。當夫妻都是基因病變攜帶者時,每次懷孕都有四分之一的機會率生育SMA嬰兒,建議孕前或懷孕初期即安排檢查,及後續必要的遺傳諮詢。
如何診斷1?
在臨床檢查中,懷疑5q-SMA的診斷時,會先進行SMN1基因測試。它涉及抽取血液樣本以確定SMN1第七外顯子的劑量。若兩個SMN1基因都缺失第七外顯子,則確認SMA的診斷。如果只有一個SMN1基因缺失第七外顯子,則需替另外那個SMN1基因進行全序列分析,以尋基因中的點突變。同時也需進行SMN2 基因劑量測試,從而確定 SMN2 基因套數。
但如果兩個SMN1基因都沒有缺失第七外顯子,則需要考慮其它神經肌肉診斷檢測,以鑑別病症。
請參閱附表二有關SMN1基因測試3種可能測試結果的總結。
附表二 替懷疑患有SMA兒童進行的指定基因缺失/複製研究
| 完整 SMN1 基因套數 | 結論/需要的進一步診斷測試 |
| 0 | SMN1的兩個基因均缺失,確認 5q-SMA的診斷。 |
| 1 | 由於只有一個SMN1基因缺失,需要在其餘那個SMN1基因進行序列分析,尋找點突變。若基因序列分析結果,顯示點突變,將會確認 5q-SMA的診斷。但若基因序列分析結果,顯示沒有點突變,則未能確認 5q-SMA,需要考慮其他鑑別診斷。 |
| 2 或以上 | 由於有2個SMN1基因存在,患上5q-SMA的可能性不大。需要考慮其他鑑別診斷作進一步檢測,如肌酸激酶(Creatine Kinase “CK”)水平,肌電圖(Electromyography “EMG”),神經傳導研究(Nerve Conduction Study “NCS”),在某些情況下,甚至要進行肌肉活檢和多基因面板,以鑒別與SMA類似的其它罕見神經肌肉疾病。 |
有甚麼治療?
2016年12月,美國食品藥品監督管理局(FDA)批准Nusinersen,也稱為Spinraza,作為第一種用於治療SMA的藥物。在香港,自2018年4月起,在該藥物未完成註冊前,本地健康情況穩定的SMA I型病人,透過 Spinraza上市前免費特別用藥計劃(EAP)接受Nusinersen治療。 2018年9月,Spinraza正式加入香港衛生署註冊的藥品清單。由於Spinraza的價格昂貴,香港特區政府正通過關愛基金提供經濟援助。在醫院管理局下,所有合資格的病人均會獲得關愛基金醫療援助計劃的支助,而專家小組會定期檢討上述支援治療計劃下的病人進度。
Spinraza,也稱為Nusinersen,是一種用於治療SMA的反義寡核苷酸。目的是通過增加包括外顯子7的SMN2 mRNA轉錄物來增加SMN蛋白水平。它通過鞘內注射將藥物施用到脊髓周圍的腦脊髓液中。最初的研究顯示,該藥物降低了死亡風險,並幫助SMA I型嬰兒和年輕的晚發性SMA II型兒童達到在沒有治療的情况下可能無法達到的兒童運動里程碑和減少呼吸系統併發症,從而使疾病變為比較溫和。
護理標準
隨著Spinraza治療的引入,遵循推薦的護理標準以確保病患者保持最佳身體健康狀況及減緩併發症產生是極其重要的。
SMA的最佳護理標準家庭指南 SMA疾病嚴重程度因不同類型而異。因此,護理方針應根據個別患者的健康狀況和身體功能水平而作出決定。詳情請參閱下面的脊髓肌肉萎縮症給家人的指引 ,其中包含有關下列護理領域最佳護理標準的詳細建議(肺部護理,餵食和營養,肌肉骨骼護理,流動性評估和干預)。該指引是根據參加SMA護理標準國際會議的一大批SMA專家製定的脊髓性肌萎縮症護理標準的共識聲明編寫的(Wang CH et al.Journal of Child Neurol 2007; 22(8):1027至1049年)。
|
以下摘錄部分護理標準建議6:
呼吸系統護理
SMA I 型和 II 型兒童的肋間肌(支撐胸壁的肌肉)較弱,使膈肌成為主要的呼吸肌。結果,他們的胸壁和肺部不能得到充分的發育,以致常出現以下的呼吸系統問題 :
- 咳嗽力微弱,未能有效清除呼吸道中粘液和其他分泌物,從而導致呼吸困難,肺炎甚至肺部衰竭。
- 睡眠期間呼吸乏力(淺呼吸和快速呼吸)。
- 餵養和吞嚥問題以致食物和液體經常從口腔進入肺部而引起肺炎。
- 反覆感染加劇呼吸肌無力。
- 呼吸肌無力導致呼吸不足。
呼吸系統問題對大多數SMA I 型和 II 型及小數 SMA III 型患者構成嚴重的健康問題,甚至會導致死亡。醫生會為患童作定期肺功能評估,如果出現上述呼吸問題,會建議適當的護理方案,其中可能包括:
- 定期進行胸部物理冶療,姿勢引流,使用咳嗽輔助機器以便清除分泌物或粘液。
- 常規呼吸練習從而加強呼吸肌。
- 使用附有 BiPAP的無創呼吸機輔助呼吸。
- 使用侵入性呼吸護理(僅用於嚴重病例或僅在醫療急診中),通過氣管插管以提供一個安全的氣道;方式有兩種, 一種是經口腔 (口腔插管), 另一種是在頸部作一小切口(氣管切開術)。
- 定期完成建議的免疫接種計劃,包括每年一次的季節性流感疫苗,以避免可預防的疾病。
胃腸道和營養護理
SMA患者易受由整體肌肉無力引起的胃腸和營養健康問題影響,其中SMA I 型和 II 型尤以為甚。由於他們的下顎和口咽肌肉太弱,增加不完全咀嚼及將食物和液體誤吸入氣道的風險。 患有SMA的兒童,尤其是沒有行動能力的SMA患者,往往難以將食物移動通過胃腸道及經常要使用藥物解決便秘問題。由於出現如胃酸倒流、嘔吐和腹脹等問題,他們容易感染吸入性肺炎。
早期的咀嚼和餵食問題,可透過進食半固體和濃稠糊狀食物,來補償咀嚼不良,以減少咀嚼的需要 (由於濃稠液體的流動較慢,孩子可以更好地協調吞嚥)。適當的膳食纖維和足夠的液體攝入量,以降低便秘的機會。他們還應該避免高脂肪飲食,因為食物中的高脂肪含量會延遲胃排空,增加胃食管反流的風險。職業治療師和物理治療師可建議餵食時的最佳位置和座位。如果口服吞嚥變得不安全或口服食物攝入總是不足以滿足營養需要,則需要干預放置飼管以提供必要的營養和水份。這將包括臨時鼻胃管(穿過鼻子和喉嚨進入胃的管)或更永久的胃造口管(通過腹壁手術放入胃內)。
SMA患兒的生長和營養狀況需要定期監測。沒有放置飼管的SMA I 型或嚴重SMA II 型兒童,由於口服攝入不良和飼料耐受性差而傾向於營養不良,體重過輕。另一方面,安置了胃食管的SMA I 型兒童和輕度SMA II 型兒童,往往攝入的劑量超過了他們的營養需要,則容易營養過剩,導致超重甚至肥胖。 SMA患兒的營養管理和護理很複雜,建議由營養師定期進行評估,制定個別患童飲食需求。
骨科護理和康復
SMA患者因腿部和手臂肌肉無力,容易導致關節緊繃 (這種情況稱為攣縮)。常規伸展運動、使用站立支架支撐站立、關節活動訓練、肌肉活動訓練和使用關節矯正器都有助於預防關節攣縮。對於失去走動能力和有限走動能力的患者,通常需要輔助助行器,手動或電動輪椅等康復設備。
髖關節半脫位和脫位,以及足部畸形,在 SMA I 型和 II 型中也很常見。脊柱側凸除了在SMA I 型和 II 型患者很常見,也可以在較晚期比較嚴重的SMA III 型患者中發生。及早使用脊柱支具、正確的坐姿以及有足夠的頭、頸和背部支撐的座椅設備,都能有效減緩脊柱彎曲和骨盆傾斜的快速惡化。如果脊柱側凸變得嚴重,可能需要進行矯正性脊柱手術。
正在進行的臨床試驗?
目前已有數個針對 SMA的新藥正在進行臨床試驗。這包括AveXis公司以一種以血清第 9 型腺病毒(adeno-associated virus serotype 9 vector,AAV9)攜帶替代SMN1基因療法臨床試驗,這種基因療法是一種一次性靜脈注射治療,對15名症狀前SMA患者進行的初步試驗,獲得令人鼓舞的結果,目前試驗範圍巳擴大至年幼的SMA I 型和 II 型患者。此外,以口服的小分子藥物的臨床試驗,包括Risdiplam(R07034067)和Branaplam(RG7916),也正在積極進行,這類藥物利用調控SMN2基因剪接,從而增加正常SMN蛋白。
其它仍在早期人體臨床試驗階段的研究藥物,包括肌肉增強療法,如 Tirasemtiv (它是一種肌鈣蛋白激活劑,可以減緩肌鈣蛋白複合物釋放鈣,從而增強肌肉收縮) 和 SRK-015 (它是一種 Myostatin 肌肉生長抑制素, 活化選擇性抑製劑,實驗証明它能促進小鼠肌肉細胞的分化)。
脊髓肌肉萎縮症給家人的指引
脊髓肌肉萎縮症孩子的診斷測試和照顧
參考/資源
- D’Amico et al., “Spinal muscular atrophy.” Orphanet Journal of Rare Diseases V6 (2011): 71
- “About SMA,” Cure SMA, accessed August 9, 2019, http://www.curesma.org/sma/about-sma/
- “The Genetics of Spinal Muscular Atrophy,” Cure SMA, published in 2009, https://www.curesma.org/wp-content/uploads/2019/07/genetics-of-sma.pdf
- “About SMA,” SMA Europe, accessed August 9, 2019, https://www.sma-europe.eu/essentials/
- MA Lorson and CL Lorson, “SMN-inducing compounds for the treatment of spinal muscular atrophy,” Future Medical Chemistry V4, 16 (2012): 2067-2084
Author manuscript, https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3589915/pdf/nihms437880.pdf - “Standards of Care for Spinal Muscular Atrophy,” Treat-NMD, last modified 2014, https://hksnmd.org/wp-content/uploads/2018/12/spinal-muscular-atrophy-care-booklet-2014-en-1.pdf
分享此頁:
-Ads by Google-
-Ads by Google-


